2020年醫療器械領域發展回顧
2020年度醫療器械重點政策分析
2020年,中國醫療器械領域重磅政策陸續出臺,包括持續推進醫療器械產品“進口替代”,強化行業監管和國際接軌、推進醫療器械注冊人制度在全國的推廣、真實世界數據用于醫療器械臨床評價、高值耗材的帶量采購、加快產品審評審批等。
優化競爭環境,國產設備“進口替代”持續推進
從原來的鼓勵國產到優先國產,再到現在的采購國產,政策為國產設備廠商提供了一個更加有利的競爭環境。2020年5月,中國醫學裝備協會公布第六批優秀國產醫療設備產品品錄,包括化學發光免疫分析儀、全自動熒光定量基因擴增儀、口腔CT、康復設備、心電圖機。同時,浙江省、廣東省、太原市等省市地區陸續出臺鼓勵公立醫院采購國產醫療設備的政策文件。這有助于持續推進國產醫療設備發展應用,降低醫療成本。
接軌國際標準,全鏈條監管體系持續強化
2020年4月,國家藥監局發布《醫療器械注冊人開展不良事件監測工作指南》,加強對醫療器械注冊人、備案人的指導、監管力度,及時、有效控制醫療器械上市后風險。同時,醫療器械唯一標識(UDI)于2020年10月1日起正式實施,標志著我國醫療器械監管將進入可追溯的信息化管理新時代。基于UDI的醫療器械監管制度將使醫療器械產品從生產、經營、使用實現全鏈條的追溯和管控,對保障患者安全、提高管理效率、降低運營成本將起到巨大作用,最終實現與國際接軌。
細化權責設計,醫療器械注冊人制度扎實推進
2020年醫療器械注冊人制度試點在北京、上海、廣東等22個省(區、市)扎實推進。截至2020年9月11日,552個產品按照醫療器械注冊人制度試點獲批上市,較2019年底增長493%。
注冊人制度囊括了設計開發、臨床試驗、生產制造、銷售配送、售后服務、不良事件監測等多個環節,其內涵界定遠不限于委托生產,一方面明確了各環節的職責劃分、法律責任承擔與監管內容,一方面也促進了技術、人才、資本等要素的自主有序流動和供給體系質量與效率的提升。醫療器械注冊人制度的試行,有效推動主體創新聚力,引導產業集聚化借力,并促進“3C”[CRO、C(D)MO、CSO]創新服務業態發力。
加強優勝劣汰,耗材帶量采購重構市場
2020年高值耗材帶量采購拉開帷幕,安徽和江蘇率先試水高值耗材帶量采購,兩省份入圍帶量采購耗材價格最高降幅達95%,平均降幅15%~74%不等。以兩省份為樣板,山西、山東、甘肅、遼寧、湖南、海南等地也開展了高值耗材帶量采購的落地探索。11月5日,國家組織首次高值醫用耗材冠脈支架集中帶量采購工作,易生科技、微創醫療、樂普醫療等8家企業的10個產品中選,冠脈支架價格將從原來的1.3萬元均價下降至700元左右。心臟支架大降價不過20天,第二批高值醫用耗材帶量采購已開始籌劃。
帶量采購倒逼生產企業加大研發投入,提升自主創新能力,同時加速行業流通市場變革,供應鏈環節不斷壓縮,龍頭企業通過收購兼并重組等方式不斷優化、重構,市場集中度將逐步提高。
規范臨床評價,明確真實世界數據研究要求
2020年3月,艾爾建公司“青光眼引流管”獲批,成為國內首個使用境內真實世界數據獲批上市的醫療器械產品,驗證了真實世界數據在臨床評價中的可行性。同年11月,國家藥監局發布了《真實世界數據用于醫療器械臨床評價技術指導原則(試行)》,明晰真實世界數據用于醫療器械評價路徑的具體要求。
真實世界數據評價在諸如進口醫療器械質量評價、同質化產品臨床評價、提供臨床評價對比參照、高風險或急需型醫械產品臨床評價等各種應用場景中至關重要,同時能推動醫械標準的更新修正,支持產品上市后監測研究。
加快產品上市,創新產品審批最快僅29天
按照常規流程,二類和三類醫療器械審批分別需要至少2年和3年時間。而據統計,已通過創新醫療器械特別審查程序上市的產品從公示到獲批上市平均用時699.7天,不到2年,最快僅用時29天;通過醫療器械優先審批程序上市的產品平均用時394.8天,最快用時103天,已大大縮短上市時間。未來隨著經驗積累和流程優化,審批時間有望進一步縮短。
2020年度醫療器械產品分析
獲批二三類醫療器械分析
三類器械首次注冊產品數量下降。2020年,國家藥監局及各省藥監局共批準二、三類醫療器械26695個,其中首次注冊16558個,延續注冊(含變更)12436個,首次注冊產品占比超過57.1%。首次注冊產品中,三類器械占比5.4%,相較于2019年的11.9%有較大降幅。
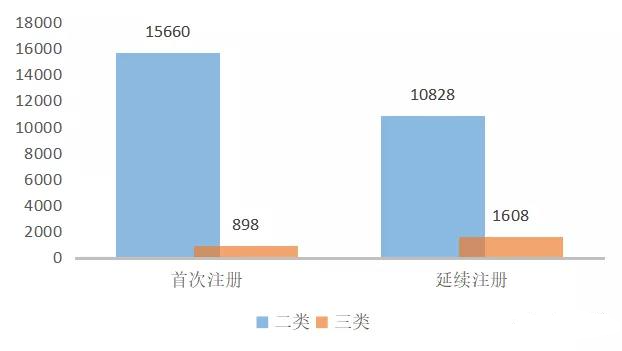
圖1 2020年我國獲批二三類醫療器械情況
創新醫療器械特別審查分析
創新醫療器械特別審查產品恢復上升趨勢。截至2020年12月31日,國家藥監局器審中心已將296個納入創新醫療器械特別審查程序的產品進行公示,并已累計有93個產品通過該程序獲批上市。其中,2020年共有53個創新醫療器械被納入特別審查,20個成功獲批上市。
在2020年創新審查公示產品中,心血管、骨科、眼科和牙科等高值耗材占比最大,共計47%;其次是醫療設備(不含體外診斷設備),占比39%;體外診斷和軟件分別占比4%和9%。
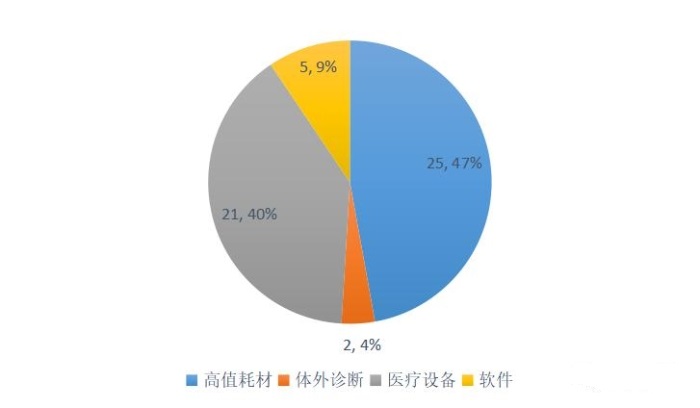
圖2 2020年創新醫療器械特別審批公示產品領域分布
四大集聚區占九成,京蘇粵滬浙牢占前五。除7個進口產品外,長三角、珠三角、京津冀和川渝四大產業集聚區進入特別審查公示的國產產品數量占了全國的87%。其中,北京(13個)、江蘇(9個)、廣東(6個)、上海(5個)、浙江(4個)牢牢占據了前五。
醫療器械優先審批分析
優先審批上市品種持續增加。截至2020年12月31日,器審中心已將45個納入醫療器械優先審批程序的產品進行公示,并已累計有22個產品通過該程序獲批上市。其中,2020年共有11個醫療器械被納入優先審批,9個成功獲批上市。
在2020年優先審批公示的產品中,國產品種7個,占全部公示品種的63.6%;進口品種4個,占比36.4%。
從2020年公示產品入選理由來看,“列入國家重點研發計劃”的產品占全部公示品種的37%,成為目前最主要的入選理由,其次是27%的“臨床急需”產品。
疫情之下的醫療器械產業
醫療器械在應急衛生體系中地位凸顯
目前,新冠肺炎疫情仍在全球范圍蔓延,疫情相關醫療物資和設備仍然緊缺。本次疫情暴露出的最大問題不是藥品,而是醫療器械。
一是應急器械物資尤其是高端產品的供應能力較弱。涉及新冠疫情防控的醫療器械多達上百種,疫情之下,口罩、防護服等醫療衛生物資短缺不足,MRI、ECMO、熒光PCR等高端醫療設備配置不足,可穿戴智能體溫測量設備、病房機器人、空氣病毒凈化系統等高科技防控產品儲備不足,以及醫護物質調運配送等應急數字化服務能力不足等問題逐漸暴露。
二是部分供應鏈環節受到制肘,關鍵技術有待突破。疫情初期的大規模爆發,造成人員隔離、物流受阻,包括新冠檢測試劑盒核心原材料NC膜在內的諸多原材料和核心部件出現供應短缺問題。與此同時,我國許多高端醫療器械核心部件仍然依賴進口,隨著部分國家采取的貿易戰以及疫情之下越來越多國家加強防控、停工停產,不少需要精密加工的核心部件也出現短缺。
疫情之下我國醫療器械領域經歷了嚴峻考驗,醫療器械應急物資在現代應急醫療體系中的重要地位進一步凸顯。未來政府將加強疫情防控體系建設,重點推動醫療器械尤其是防疫必需品的長期戰略儲備,同時加強醫療器械產業的轉型升級和技術突破,重點進行強鏈補鏈,實現關鍵原材料和核心部件的良好內循環。
疫情防控產品爆發式獲批上市
疫情之下,醫療器械應急審批程序啟動。為了應對突發的新冠肺炎疫情,國家藥監局啟動醫療器械應急審批程序。各省級藥監局相繼批準應急產品上市,產品有效期從三個月、六個月到兩年、五年不等。據統計,2020年全國共批準口罩6400余個、額溫計340余個、防護服620余個,均是尋常年份的幾十倍甚至幾百倍。
截至2020年12月31日,全國共有51個新型冠狀病毒檢測試劑盒和1個新冠病毒核酸分析軟件獲批上市,其中核酸檢測試劑盒24個,基于化學發光、酶聯免疫、膠體金等的其他免疫診斷方法的試劑盒27個。
疫情之下的2020年,我國醫療器械領域的變化很大程度上都與疫情有直接或間接的聯系,比如對防護用品等的應急審批使得口罩、防護服等相對低值的耗材大量上市,使得整體三類器械占比下降。整體上,國產化、智能化、高端化的發展方向并無變化,并且隨著高值耗材帶量采購、醫療器械注冊人制度試點推進等工作的不斷深化和落實,未來我國醫療器械領域的產業結構將更加合理,產品競爭力也必將進一步提升。
來源:中國食品藥品網